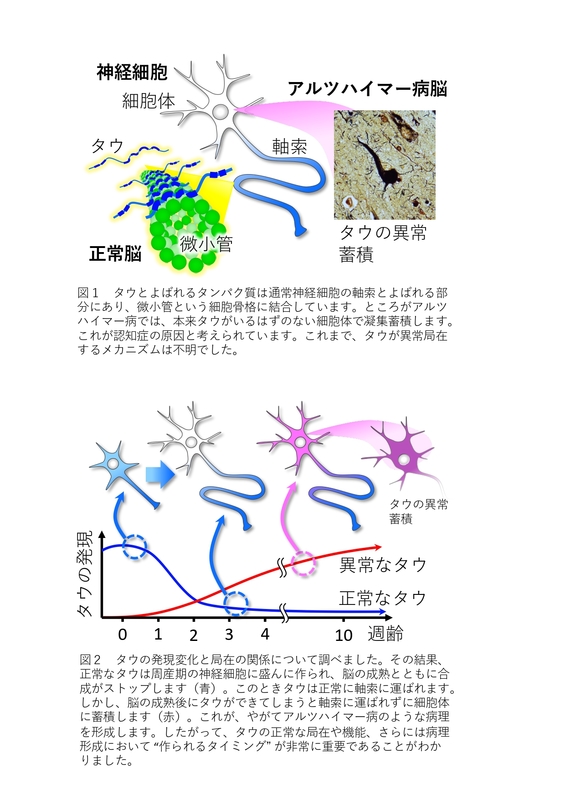
タウタンパク質(タウタンパクしつ、英: Tau protein)は、微小管を安定化するタンパク質である。ギリシャ文字の τ(タウ)を用いて、τタンパク質と表記されることもある。タウタンパク質は中枢神経系の神経細胞に豊富に存在するが、他の部位では一般的ではない。中枢神経系のアストロサイトやオリゴデンドロサイトでも極めて低レベルで発現している。アルツハイマー病やパーキンソン病のような神経系の病理や認知症は、適切な微小管安定化能を失ったタウタンパク質と関係している。
タウタンパク質は、ヒトでは17番染色体に位置するMAPT (microtubule-associated protein tau) と名付けられた単一の遺伝子からの産物であり、選択的スプライシングによって複数のアイソフォームが合成される。
タウタンパク質は微小管の重合に必須の熱安定性タンパク質として1975年に同定され、その後天然変性タンパク質として特徴づけられた。
機能
タウタンパク質は、非常に可溶性の高い微小管結合タンパク質 (microtubule-associated protein, MAP) である。ヒトでは、これらのタンパク質は大部分が神経細胞にみられる。タウの主要な機能の1つは、軸索の微小管の安定性の調節である。タウのノックアウトマウスが脳の発達に異常を示さないことから、他の神経系のMAPも同様の機能を果たしていることが示唆され、おそらくタウの欠損は他のMAPによって補われていると考えられる。タウは主に軸索の遠位端側で活性があり、微小管の安定性と必要時には柔軟性をもたらす。これは、軸索の近位端側で微小管を固定するMAP6や、樹状突起で微小管を安定化するMAP2と対照的である。微小管安定化機能に加えて、タウはシグナル伝達タンパク質のリクルートや微小管を介した輸送の調節を行っている。
タウはチューブリンと相互作用して微小管を安定化し、チューブリンの微小管への重合を促進する。タウには、アイソフォームの変化とリン酸化という2つの微小管の安定性を制御する2つの方法が存在する。
遺伝学
ヒトでタウタンパク質をコードするMAPT遺伝子は17q21に位置し、16のエクソンを含む。ヒトの脳での主要なタウタンパク質は11のエクソンによってコードされている。エクソン2、3、10は選択的スプライシングを受け、6種類のアイソフォームが形成される。ヒトの脳では、352–441アミノ酸の6種類のアイソフォームがファミリーを構成している。タウのアイソフォームは、N末端部分に29アミノ酸の挿入の数が0、1、2個(エクソン2、3)、そしてC末端部分の反復配列が3つもしくは4つ(エクソン10)という違いがある。そのため、中枢神経系で最も長いアイソフォームは4つの反復 (R1、R2、R3、R4) と2つの挿入を有し(全長は441アミノ酸)、最も短いアイソフォームは3つの反復 (R1、R3、R4) を持ち、挿入は存在しない(全長は352アミノ酸)。
MAPT遺伝子にはH1とH2という2つのハプログループが存在し、それぞれは逆向きに存在している。ハプログループH2はヨーロッパの人々またはヨーロッパに祖先をもつ人々にのみ普遍的に存在する。ハプログループH1はアルツハイマー病などの特定の認知症の可能性の増加と関連しているようである。ヨーロッパで双方のハプログループが存在していることは、逆向きのハプロタイプ間の組み換えによって遺伝子の機能的コピーの1つが失われ、先天的欠陥がもたらされる可能性があることを意味している。
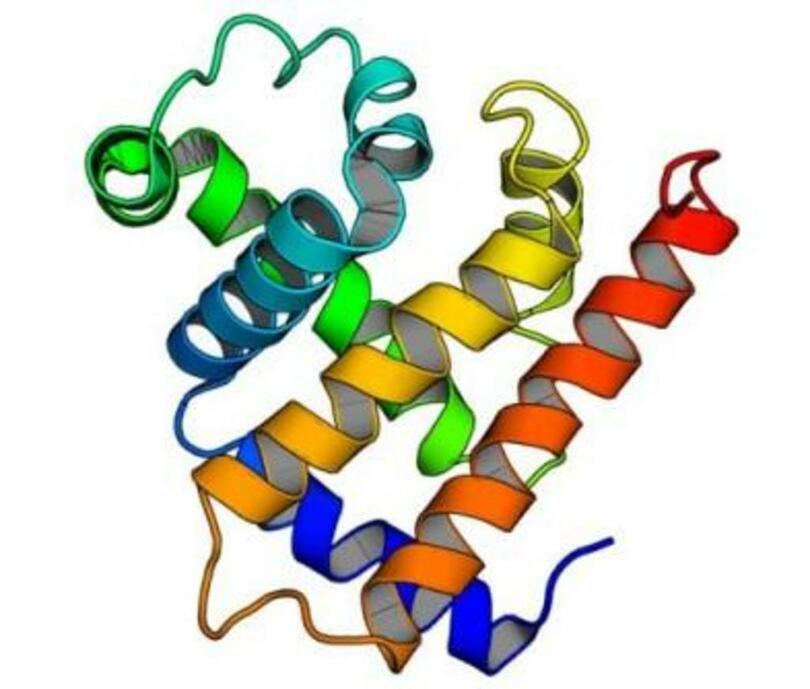
構造
ヒトの脳組織には6種類のタウのアイソフォームが存在しており、それらは結合ドメインの数によって区別される。3種類のアイソフォームは3つの結合ドメインを持っており、その他は4つの結合ドメインを持っている。結合ドメインはタンパク質のC末端に位置しており、正に帯電している(それによって負に帯電して微小管に結合することができる)。4つの結合ドメインを持つアイソフォームは、3つのものよりも強い微小管安定化効果を持つ。タウはリン酸化タンパク質であり、最も長いアイソフォームにはセリン/スレオニンのリン酸化部位が79か所存在する。正常なタウタンパク質は、これらのうち約30か所がリン酸化されているという報告がある。
タウのリン酸化は、PKNを含む、セリン/スレオニンキナーゼによって調節される。PKNが活性化されるとタウをリン酸化し、微小管構造が破壊される。タウのリン酸化は発生段階でも調節されている。例えば、胚の中枢神経系のタウは成体のタウよりも高度にリン酸化されている。6つの全てのアイソフォームのリン酸化度は、ホスファターゼの活性化のために年齢とともに低下する。キナーゼと同様に、ホスファターゼもタウのリン酸化を調節している。例えば、PP2AとPP2Bはともにヒトの脳組織に存在し、396番のセリン残基を脱リン酸化する能力を持つ。これらのホスファターゼのタウへの結合は、タウの微小管への結合に影響を与える。
タウが関与する機構
過剰なリン酸化がなされたタウの神経細胞への蓄積は、神経原線維変性 (neurofibrillary degeneration) を引き起こす。タウがある細胞から他の細胞へ伝播する実際の機構については特定されていない。また、タウの放出や毒性など他の機構も未解明である。タウが凝集すると、チューブリンに置き換わってタウの線維化が増大するようになる。伝播の方法に関しては、シナプスの細胞接着タンパク質や神経活動のようにシナプス結合を介した機構や、他のシナプス機構、非シナプス機構など、いくつかの機構が提案されている。タウの凝集の機構は完全には解明されていないが、タウのリン酸化や亜鉛イオンなど、この過程の進行を促進するいくつかの因子が知られている。
タウの放出
タウの取り込みと放出の過程は、シーディング (seeding) として知られている。タウタンパク質の取り込みは、細胞表面にヘパラン硫酸プロテオグリカンの存在を必要とし、マクロピノサイトーシスによって起こる。一方で、タウの放出は神経活動に依存している。Asaiらによると、タウタンパク質の拡散は、疾患の初期段階で嗅内野 (entorhinal cortex) から海馬領域へ起こる。また、彼らはミクログリアが輸送過程に関与していることを示唆したが、その実際の役割は不明である。
タウの毒性
タウは細胞内に蓄積することで毒性を示す。この毒性の機構には、PAR-1キナーゼなどの多くの酵素が関与している。この酵素は262番と356番のセリン残基のリン酸化を促進し、他のキナーゼ(GSK-3とCdk5)を活性化して疾患と関連したリン酸化エピトープを作り出す。毒性の程度は、微小管への結合度などのさまざまな因子の影響を受ける。また、毒性は神経原線維変化 (neurofibrillary tangle) によっても引き起こされ、細胞死や認知機能の低下がもたらされる。
臨床的重要性
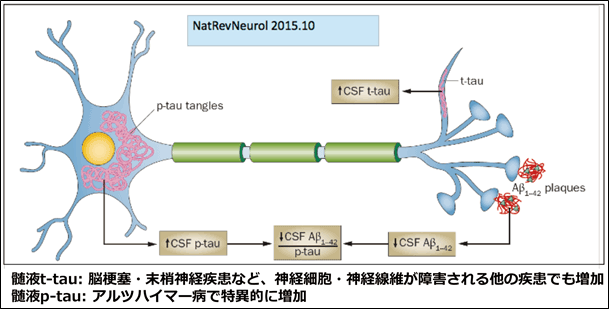
タウタンパク質の過剰なリン酸化(タウ封入体、pTau)は、対らせん状細線維 (paired helical filament) と直線状細繊維 (straight filament) の凝集体の自己集合を引き起こす。これらは、アルツハイマー病、前頭側頭型認知症や他のタウオパチーの病理に関係している。
アルツハイマー病の脳の対らせん状細線維では、タウの6つのアイソフォームの全てがしばしば過剰なリン酸化がなされた状態で存在している。他の神経変性疾患では、蓄積した凝集体には特定のアイソフォームが多く含まれることが報告されている。誤ったフォールディングが起こることで、可溶性の高いタンパク質も極めて不溶性の凝集体を形成し、多くの神経変性疾患に寄与する。
神経原線維変化 (neurofibrillary tangle) はタウタンパク質が互いに結合した凝集体で、脳の細胞へ分配される必須栄養素を遮断することで細胞死を引き起こす。
アルツハイマー病において、タウはエクソソームを介した機構で細胞外へ放出されていることが近年の研究では示唆されている。
ヒトの脳のさまざまな領域でのジェンダー特異的なタウの遺伝子発現とタウオパチーの症状やリスクのジェンダー間の差異との関係が近年示唆されている。
疾患の機能のいくつかの側面は、プリオンタンパク質との類似性が示唆される。
外傷性脳損傷
反復性の軽度外傷性脳損傷は、現在ではコンタクトスポーツ(特にアメリカンフットボール)や、軍隊における爆風の震動による脳損傷の中心的要素であると認識されている。慢性外傷性脳症へとつながることもあり、この疾患は過剰にリン酸化されたタウによる神経原線維変化で特徴づけられる。
脳の細胞外空間における高レベルのタウタンパク質は、脳外傷後の予後不良と関連している。
アルツハイマー病のタウ仮説
アルツハイマー病のタウ仮説では、タウの過剰なまたは異常なリン酸化が、正常な成人のタウを対らせん状細線維へ変化させたり神経原線維変化 (NFT) を引き起こしたりするとされる。疾患の段階によってタウのリン酸化状態は異なっており、NFTは pre-neurofibrillary tangle、intra-neuronal neurofibrillary tangle、extra-neuronal neurofibrillary tangleという段階で進行するが、pre-NFTの段階では119番、202番、409番のセリンがリン酸化されており、intra-NFTでは396番のセリンと231番のスレオニンがリン酸化される。
タウの変異によって、アイソフォームの発現レベルの変化や微小管の機能異常など多くの結果が引き起こされる。タウの機能やアイソフォームの発現を変化させる変異によって、タウの過剰なリン酸化が引き起こされる。変異のないタウが凝集する過程は解明されていないが、リン酸化の増加やプロテアーゼの作用、グリコサミノグリカンなどのポリアニオンへの曝露の結果であると考えられている。過剰なリン酸化がなされたタウは微小管を解体し、タウとユビキチンを対らせん状細線維へ隔離する。この不溶性の構造体は細胞質の機能に損傷を与え、軸索輸送に干渉することで細胞死を引き起こす。
異常な形態のタウタンパク質を攻撃させるワクチンが開発されている。これによってアルツハイマー病の症状が緩和され、最終的には治癒が可能となるかもしれない。
相互作用
タウタンパク質は、がん原性のチロシンキナーゼなどと相互作用することが示されている。
- α-シヌクレイン
- FYN
- S100B
- YWHAZ
出典
関連文献
関連項目
- タウオパチータウタンパク質の蓄積と関連した疾患の総称
- 慢性外傷性脳症
- アルツハイマー病
- 原発性年齢関連タウオパチー
- 大脳皮質基底核変性症
- 進行性核上性麻痺
- プロテオパチー
- ピック病
- FTDP-17
- プリオン
外部リンク
- tau Proteins - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
- GeneReviews/NCBI/NIH/UW entry on MAPT-Related Disorders
- MR scans of variant CJD CSF Tau positive man