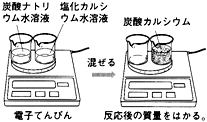
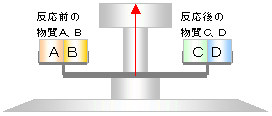
質量保存の法則(しつりょうほぞんのほうそく、英: law of conservation of mass)とは、閉鎖系においては時間が経過しても物質の総質量が保たれるという物理学および化学の法則である。閉鎖系内で物質が移動したり、その形状が変化することはあっても質量そのものが生み出されたり、消失したりすることがないことを意味する。例えば化学反応の前の質量と後の質量は等しくなる。質量保存の概念は、化学、力学、流体力学などの多くの分野で広く使用されている。化学反応における質量保存の法則は、18世紀後半にアントワーヌ・ラヴォアジエが精密な実験を行い、提唱した。この法則は、錬金術から化学の現代自然科学への進歩の歴史において非常に重要であった。実際には質量保存の法則は古典力学における仮定のひとつにすぎず、自然の基本法則ではないことが知られており、特殊相対性理論における質量とエネルギーの等価性に従うように修正する必要がある。さらに非常にエネルギーの高い系では、素粒子物理学における核反応や粒子-反粒子消滅の場合のように、質量の保存は成り立たないことが示されている。質量保存則ともいう。
概説
素粒子論・核物理・宇宙論などを除く自然科学のほとんどの分野で実用上用いられている法則である。
化学反応の前後で質量変化が実験的に観測されなかったことから生まれた法則だが、現在では相対性理論に基づく質量とエネルギーの等価性がより根本的な法則で、質量保存の法則はその近似に過ぎないとされている。もっとも、質量とエネルギーの等価性は自然科学の多くの分野では問題とならず、質量保存の法則は多くの場面で運用上有効な法則である。
物質の根源に迫ることを目的とした素粒子論や宇宙論などの研究対象においては、質量保存の法則は全く成り立っていない。たとえば培風館の物理学辞典には、かつて「物質は不滅だ」などと考えられていた時代があったので、こうした法則が主張されたが、「こうした考えは捨てなければならない」と書かれている。
核反応の世界では実験的に十分に測定可能なだけの質量変化が起こっており、反応の前後で元素の種類や各々の物質量も変化していく。さらに、素粒子論の世界では物質・質量の生成や消滅が広範に起こっている。これらの世界においては、質量保存の法則や物質の不変性・不滅性は全く成り立っていない。
化学反応においても、反応によって放出または吸収されたエネルギーに相当する質量変化が起こっており、質量は厳密には保存されていないとされる。そのことを考慮に入れると「化学反応の前後で、それに関与する元素の種類と各々の物質量は変わらない」という表現がより正確な表現となる。
アメリカやヨーロッパの初等教育では「化学反応の前後で質量の総和は変わらない」というようなlaw of conservation of mass(質量保存の法則)の指導はあまりされておらず、化学反応で保存されるのは物質量であることを強く押し出すためprinciple of mass/matter conservationと表記される。
歴史
身近な化学反応である燃焼について考察すると、木や紙は燃やすと灰となって質量が大幅に減少する(反対にスチールウールなどの金属は質量が増加する)。また、(熱気球に端的に見られるように)、気体を熱するとそれは軽くなるように感じられる。つまり日常的な感覚や直感では反応の前と後では、ものの質量は大きく変化するように感じられる。しかし、このような目に見える質量の変化はあくまで外部との物質の出入りが自由な開放系で見られるものであり、精密な測定のために閉鎖系を準備すると状況は違ってくる。
保存則は古代から提唱されていた。例えば紀元前4世紀頃にエンペドクレスは「なにものも無に移り変わることはできず、存在するものは永遠に存在し続ける。無から有は生成しない」と述べた。また紀元前3世紀頃にエピクロスは「過去において物事の全体は常に現在のようであり、将来についても常にそうである」と述べた。
フランスの科学者、アントワーヌ・ラヴォアジエは1774年、当時としては精密な定量実験を行った結果、化学反応の前後では質量が変化しないとの結論を得て、後にこれを「質量保存の法則」として元素の概念と共に提唱した。ラヴォアジエは、化学反応によっては元素が分裂して増加したり、消滅して減少したり他の元素に転化したりしない、と述べたのであった。 (なお、この考えから出発して、定比例の法則と倍数比例の法則が発見され、原子、分子および化学量論の概念が確立してゆくことになり、ラヴォアジエは「近代化学の父」と呼ばれることになる。)
これらの考え方をさらに拡張して、物質は不滅であるとする「物質不滅の法則」が唱えられるようになった。
しかし20世紀初頭にアルベルト・アインシュタインは相対性理論において E=mc² という数式を提示し、質量とエネルギーは等価関係にあるとすることを提唱した(質量は消滅してエネルギーに変化しうる、とすることを提唱した)。相対性理論の有効性が明らかになると、質量保存の法則や物質不滅の法則は、自然の基本法則としては完全に破棄されることとなった。
相対性理論以前の物理学・化学では、閉じた系の「質量の総和が一定である」ということを公理として扱っていた。しかし、相対性理論を考慮に入れた現代物理学では、「質量の総和が一定である」という命題は日常的な場面において、あくまで近似的に成立するものであるとされている。
特殊相対性理論によれば、質量とエネルギーは等価であり、閉じた系において保存されるのは「質量の総和」ではなく「(質量を含む)エネルギーの総和」であるとされる。従って、化学反応によってエネルギーが吸収・放出されれば、それだけ質量も変化することになる。
高エネルギーの素粒子反応においては粒子が消滅したり、新しく創られたりすることは、ごく普通の現象である。
実用上の取扱い
質量保存の法則は、自然の基本法則ではないものの、素粒子論・核物理・宇宙論などを除く自然科学のほとんどの分野で実用上の基本法則として用いられている。これらの分野における質量保存の法則の妥当性は、質量の変化には極めて莫大な量のエネルギーの放出・吸収が伴うとする E=mc² の式から逆に保証される。
したがって、化学実験などにおいて「質量保存の法則」や「物質不滅の法則」に反する結果が得られた場合は、質量保存の法則によらない反応が起こったと考えるのではなく、実験に不手際がなかったか、結果の解釈に問題がないかを十分に考察する必要がある。
関連項目
- 保存則
- 物質収支
- 定比例の法則
- 倍数比例の法則
- エネルギー保存の法則
- 連続の方程式
脚注
出典